এই এক জীবনে ইলেকট্রন বিন্যাস আর কীভাবে পরমাণুতে ইলেকট্রন নামক চিড়িয়াটি প্রবেশ করে এবং বের হয় সেটা নিয়ে কম প্রশ্ন শুনিনি। নিজেরও যে কৌতূহল কম ছিল, সেটাও বলব না। এইসব কিছুর ফলাফল হিসাবে লেখাটি জন্ম নিল। এই প্রজেক্ট চলতে থাকবে। এই প্রজেক্টের নাম দেয়া হলো- ‘উচিত শিক্ষা’ প্রজেক্ট। নিজের কাজে না লাগলেও স্কুল- কলেজ পড়ুয়া শুভাকাঙ্ক্ষীদের কাজে লাগবে। ধন্যবাদ।
পর্যায় সারণি এবং আউফবাউঃ
‘আউফবাউ নীতি’ স্কুল-কলেজ জীবনের সবচেয়ে পরিচিত এবং কাজে লাগা থিউরিগুলোর মধ্যে একটা। কোন মৌলের ইলেক্ট্রন বিন্যাস বা পর্যায় সারণি ব্যাখ্যা করতে গেলে এই নীতি ছাড়া আমরা রীতিমত অচল। প্রজন্ম-প্রজান্মান্তরে বয়ে চলেছে এই নীতিটি, জীবনে এবং পরীক্ষার প্রশ্নে। যখন আমি এই লেখাটি লেখছি, এই বছরের (২০১৮) এইচ এস সি পরীক্ষাতেও এখান থেকে একটি প্রশ্ন এসেছে! (সতর্কতাঃ আউফবাউ নীতি সুন্দর করে বুঝিয়ে বলে পরীক্ষায় ভালো মার্ক পাওয়ার জন্য এই লেখাটির জন্ম হয় নি!) বরং এই লেখাটির মূল উদ্দেশ্য ‘আউফবাউ নীতি’র থলের বিড়ালটিকে বের করে আনা। বুঝানো, কত খানি ভুলে ভরা এই থিউরিখানি। সমস্যাগুলো বেশ সুক্ষ হওয়ায় প্রায়ই আমাদের বই এবং টিচারদের চোখ এড়িয়ে যায়। এতেই ঘটে যত বিপত্তি!
ভুলের উৎপত্তি সম্ভবত জিনিসপত্রকে অধিক সরলীকরণ করে পোলাপানের কাছে উপস্থাপনের ‘নিষ্পাপ চেষ্টা’ থেকে! অথবা দেখে শুনেই ছাড় দেয়ার চেষ্টা। যেটাই হোক, থিউরিটি কি কোন পরম সত্য নাকি একটা মিথ এটাই একটা গবেষণার বিষয়!
সমস্যাটাঃ
আউফবাউ নীতি এসেছিল নীলস বোর এর হাত ধরে। নীলস বোর কে তো আমরা চিনি, নাকি!
পরমানুর গঠনের সাথে কোয়ান্টাম মেকানিক্সকে মাখিয়ে দিয়েছিলেন যিনি! তার কাছ থেকেই আমরা প্রথম জেনেছিলাম, পর্যায় সারণিকে কে যে ইলেক্ট্রন বিন্যাসের মাধ্যমে ব্যাখ্যা করা যায়। তার মতে, সবচেয়ে সরল পরমাণুটির মধ্যে একে একে ইলেক্ট্রন দিয়েই পর্যায় সারণিটি তৈরি হয়েছে। সরলতম পরমাণুটি হচ্ছে হাইড্রোজেনের, এক প্রোটন- এক ইলেকট্রনের। এবার একটি করে ইলেকট্রন এবং প্রোটন বাড়াতে থাকলে নতুন নতুন পরমানু গঠিত হতে থাকবে। যেমন, হিলিয়ামের ২-২, লিথিয়ামের ৩-৩ এররকম করতে করতে ইউরেনিয়াম (৯২-৯২) পর্যন্ত। বলে রাখা ভাল, বোরের আমল পর্যন্ত (১৯১৩) ইউরেনিয়াম ছিল ভারীতম মৌল।
আচ্ছা, পরমানুতে নিউট্রন সংখ্যা অবশ্য নানা রকম হতে পারে। দুঃখজনক হলো, আমাদের গল্পে নিউট্রনের ভূমিকা নাই!
এরপর ‘অরবিটাল’ এর ব্যাপারে জানা দরকার। কারণ এই অরবিটালগুলতেই সিরিয়ালি ইলেকট্রন প্রবেশ করে। একেবারে সরল করে বললেও, অরবিটালের জন্ম অবশ্য শ্রোডিঞ্জারের সমীকরণ সমাধান থেকে! এদিকে আগাতে থেকে আমরা মূল টপিক থেকে দূরে যেতে চাচ্ছি না।
অরবিটালঃ
আমাদের কাছে নানা রকমের উপশক্তিস্তর আর অরবিটাল আছে। s,p,d আর f। প্রতিটা শক্তিস্তরের ভিতরে ঘাপটি মেরে আছে অনেকগুলো করে অরবিটাল। নিউক্লিয়াস থেকে আমরা যত দূরে যেতে থাকি শেলের ভিতরের সাবশেল (উপশক্তিস্তর) বাড়তে থাকে, অরবিটালের সংখ্যাও তত বাড়তে থাকে।
সবার জানা নিয়মটা আরেকবার মনে করিয়ে দেই-
১ম শেল
শুধুমাত্র 1s উপশক্তিস্তর
২য় শেল
2s,2p
৩য় শেল
3s,3p,3d
৪র্থ শেল
4s,4p,4d,4f
প্রত্যেকটা উপশক্তিস্তরে (2l+1)সংখ্যক অরবিটাল থাকে।
s এর জন্য l=0, p এর জন্য l=1, d এর জন্য l=2 etc.
এই পর্যন্ত সব ঠিকই ছিল। ঝামেলা শুরু হলো যখন আমরা খোঁজা শুরু করলাম কোন নিয়মে এই অরবিটালগুলো সিরিয়ালি পূর্ন হয়। নিউক্লিয়াসের চারদিকে যে শেলগুলো থাকে সেগুলো সিরিয়ালি একটার পর একটা পূর্ন হতে থাকবে, একটা শেল পুরোপুরি ভরে গেলে এরপর ইলেকট্রন পরের শেলে যাবে – হতেও পারত নিয়মটা এমন সরল এবং স্বাভাবিক। কিন্তু হয় নি!
বরং আমাদের জানানো হলো, ইলেকট্রন এমন সহজ সিরিয়ালে পরমানুতে প্রবেশ করে না। আমরা যেন টেনশন না করি সে জন্য এরপর আমাদের আশ্বস্ত করা হলো যে, আকর্ষণীয় একটা প্যাটার্ন আছে যেটা মন্ত্রের মত যপতে থাকলে সিরিয়ালি সঠিকভাবে অরবিটাল এবং শেলগুলো পূরণ হতে থাকবে!
এই সেই সর্পিল মন্ত্র – আউফবাউ নীতি। সব সমস্যার মূল!
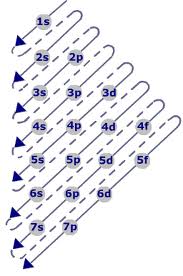
উপশক্তিস্তরে ইলেকট্রন প্রবেশের নিয়ম ধরা হয় একেবারে উপর থেকে নিচের দিকে তীর চিহ্ন বরাবর সিরিয়ালি। সেই হিসাবে, ইলেকট্রন প্রবেশের সিরিয়াল দাঁড়ায়-
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d …
কোন উপশক্তিস্তরে কয়টা করে ইলেকট্রন জায়গা হয় এটা জানা থাকলে উপরের সিরিয়ালটার সাহায্য নিয়ে যে কোন পরমানুর পুরো ইলেকট্রন বিন্যাস কেমন হওয়া উচিত সেটা আমরা বুঝতে পারি। যদিও অন্তত ২০টা পরমানু পাওয়া যাবে খুঁজলে যেখানে নানা অনিয়ম চলছে! উদাহরণ হিসাবে, ক্রোমিয়াম- কপারের কথা বলা যায়। মূল টপিক থেকে দূরে যেতে চাচ্ছি না বলে এইসব অনিয়মের উদাহরণ বাদ দিয়ে নিয়ম মেনে চলে এমন একটা উদাহরণ নিয়েই একটু খুঁটিয়ে দেখা যাক...
কেমন ভুলঃ
এই সরল কিন্তু ভুলে ভরা পদ্ধতিটা কাজ করে কীভাবে দেখে নেয়া যাক একটু-
ম্যাগনেসিয়াম পরমানুতে ইলেকট্রন থাকে ১২ টা। উপরে বিবৃত পদ্ধতি অনুযায়ী এর ইলেকট্রন বিন্যাস দাঁড়ায়-
1s2, 2s2, 2p6, 3s2
যা খুব সুন্দর ভাবেই বর্নালী পরীক্ষার মাধ্যমে পাওয়া ফলাফলের সাথে মিলে যায়। ক্যালসিয়ামের ২০ টি ইলেকট্রনের জন্যও একই অবস্থা। আউফবাউ নীতি থেকে পাওয়া বিন্যাস-
1s2, 2s2, 2p6, 3s2, 3p6, 4s2
সুন্দরভাবে মিলে যায় পরীক্ষালব্ধ ফলের সাথে।
ধীরে বতস্য! এত পুলকিত হওয়ার কিছু নাই! কারণ এর পরের পরমাণুটির দিকে যদি তাকাও (স্ক্যান্ডিয়াম,২১) আউফবাউ নীতি অনুযায়ী বিন্যাস দাঁড়ায়-
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d1
কী ভাবসো, এটা ভুল?
– নাহ! এটাও আসলে ঠিকই আছে
কিন্তু ঘটনাটা প্যাচ খেয়েছে অন্য জায়গায়। প্রায় সব বইতেই দাবী করে এখানে শেষ ইলেকট্রনটা (২১তম) 3d তে প্রবেশ করে যেখানে পরীক্ষা-নিরীক্ষায় পরিষ্কার ভাবে জানা যায়, 3d উপশক্তিস্তর পূরণ করে তারপর ইলেকট্রন 4s এ যায়! সঠিক ভার্সনওয়ালা বইগুলো এখন নাই বললেই চলে!
কিন্তু কথা হচ্ছে এত বড় একটা ভুল কি করে হলো!!!!
ভুলের কারনঃ
সত্যিই কি অবাক করা না? এত বড় ভুল তাও আবার কেমিস্ট্রির একেবারে বেসিক একটা বিষয়ে! কারণটা অনুসন্ধান করলে মজার কিছু ব্যাপার বের হয়ে আসে-
প্রথমত, যত যা ই হোক, ওভার অল ইলেকট্রন বিন্যাস কিন্তু ঠিকই আছে। শুধু কোন সিরিয়ালে ইলেকট্রন প্রবেশ করছে- সেটা নিয়ে সমস্যা। আমাদের বিখ্যাত আউফবাউ নীতি সেই প্রশ্নটির উত্তর দিতে পারছে না! এর চেয়েও ভয়ানক ব্যাপার হচ্ছে এই নীতিটি টিচার এবং স্টুডেন্টদের আরও অস্পষ্ট মনগড়া থিউরি দাঁড় করাতে উসকে দিচ্ছে! কারণ পরীক্ষায় কিন্তু ঠিকই জানতে চাওয়া হচ্ছে – 3d অপেক্ষা 4s এ ইলেকট্রন আগে প্রবেশ করে কেন? বা, 4s এ ইলেকট্রন ঢুঁকে আগে তারপর 3d তে, কিন্তু আয়নিত করার সময় কেন 4s থেকেই ইলেকট্রন আগে বের হয়?
এরকরম আরও কত শত ভুল প্রশ্নের জন্য আমরা সৃজনশীলভাবে ভুল উত্তর বের করছি সেই আলোচনায় আর না ই বা গেলাম।
লজিক তো সিম্পলই ছিল- 4s এ প্রকৃতপক্ষে ইলেকট্রন ঢুঁকে সবার পরে তাই বের হওয়ার সময় বেরও হয় আগে আগে।
প্রুফ কী তারঃ
কীভাবে আমরা এত গলা উচিয়ে বলতে পারছি যে বই এবং টিচাররা আমাদের ভুল থিউরিটাই শিখাচ্ছেন সেটা বুঝতে গেলে যে কোন একটা অবস্থান্তর মৌলের (ধরি, স্ক্যান্ডিয়াম) আয়নের দিকে চোখ রাখা যেতে পারে-
Sc3+ (tripositive ion) 1s2, 2s2, 2p6, 3s2, 3p6, 3d0, 4s0
Sc2+ (dipositive ion) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s0
Sc1+ (mono-positive ion) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s1
Sc (neutral atom) 1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s2
উপরের এই ইলেকট্রন বিন্যাসগুলো আমাদের খুবই পরিচিত। এবার খুব মনোযোগ দিয়ে দেখো-
আমরা যদি Sc3+ থেকে Sc2+ এর দিকে আগাই, তাহলেই স্পষ্ট দেখা যায়, নতুন আসা ইলেকট্রনটা একটা 3d তে ঢুকছে, 4s এ না!!!!!!
এরপর Sc2+ থেকে Sc1+ এ দেখা যাচ্ছে, নতুন ইলেকট্রনটি একটি 4s এ প্রবেশ করে। এভাবে আরেকটি ইলেকট্রন এসে শেষ পর্যন্ত নিরপেক্ষ পরমাণুটি গঠিত হয়।
শুধু এই পরমাণুটি নয়, আশেপাশের আরও অনেকগুলো (টাইটেনিয়াম, ভ্যানাডিয়াম, ক্রোমিয়াম ইত্যাদি) পরমাণুতে এই একই প্যাটার্ন দেখা যায়।
মনস্তাত্ত্বিক ব্যাপারঃ
এবার যদি আমরা তদন্তে আসি, কেন এই আউফবাউ নীতি টিকে আছে। প্রথমত আমরা আগেই বলে ফেলেছি, এই নীতি প্রায় সবার জন্যই ওভার অল বিন্যাসটা ঠিক দেখায়। যদিও প্রায় ২০টা মৌল পাওয়া যাবে যারা একটু এদিক-সেদিক হয়ে যায়!
আরেকটা ব্যাপার হলো এটা কেমিস্ট্রি টিচারদের একটা ভাব নেয়ার সুযোগ দেয়। এমন একটা ভাব যে, উনারা জানেন একদম, একটা নিউক্লিয়াস থেকে শুরু করে একে একে ইলেকট্রন যুক্ত হলে কে কোথায় যাচ্ছে!
এমন কি স্টুডেন্টরাও যে এই নীতির বড় ভক্ত, তার একটা বড় কারণ হচ্ছে এতে করে পরমাণুর উপর আমাদের কিঞ্চিত কর্তৃত্ব প্রতিষ্ঠা পায়!
কিন্তু আসল ব্যাপার হলো, কোন অবস্থান্তর মৌলের জন্য এই বিন্যাস বুঝার উপায় নাই। এমনকি ল্যান্থানাইডস এবং কিছু ক্ষেত্রে এই কথা p-ব্লকের জন্যও সত্য!
আবার আমরা স্ক্যান্ডিয়ামের ফেরত আসি। আউফবাউ নীতির বিপরীতে দাঁড়িয়ে বলতে হয়, 3d এর শক্তি কম, 4s এর শক্তি বেশী। আমরা যদি একটু আইডিয়া করতে চাই কীভাবে এরপর ইলেকট্রনগুলো ঢুকছে তাহলে বলতে হয় কোর ইলেকট্রনের লেয়ারটা
1s2, 2s2, 2p6, 3s2, 3p6
পার হওয়ার পর হয়ত আমাদের আশা করা উচিত ছিল ইলেকট্রন সব 3d তে এসে ঢুকবে। এবং বিন্যাসটা এমন হবে-
1s2, 2s2, 2p6, 3s2, 3p6, 3d3
কিন্ত আসলে সেটাও তো হয় না। হয় এমনটা-
1s2, 2s2, 2p6, 3s2, 3p6, 3d1, 4s2
আসলে হচ্ছে টা কীঃ
শেষ ৩টা ইলেকট্রন আসলে 3d তেই ঢুঁকে। এরপর দুইজন বিকর্ষিত হয়ে উচ্চ শক্তির 4s এ গমন করে। কারণ এতে ওভার অল পরমাণুটির কিছু সুবিধা হয়। কিন্তু এই জিনিস কি আমার আগে থেকে জানার বা বুঝার কথা?
উত্তর হচ্ছে- নাহ!
কেন দুইটা ইলেকট্রন বিকর্ষিত হচ্ছে, একটা বা তিনটাই না? কেন ক্রোমিয়াম বা কপারের ক্ষেত্রে একটা মাত্র ইলেকট্রন 4s এ যাচ্ছে? – এসবের কোন কিছুই কিন্তু খুব সহজ কোন উপায়ে বুঝে ফেলা সম্ভব না। কিন্তু আমরা ওভার অল বিন্যাস ঠিক থাকে এমন এক রব তুলে এই বুঝতে না পারার ব্যাপারটাকে ধামাচাপা দিয়ে ফেলি। আর আমরা যারা বিজ্ঞানের বিজয়ী চেহারাটাকে পছন্দ করি এবং প্রোমোট করি তাদের জন্যও ব্যাখ্যা করতে না পারা অংশটা একটু বিব্রতকর বটে।
শেষ কথাঃ
আসলে এই পিচ্ছিল আউফবাউ নীতিটি বই পত্র বা ক্লাসরুমে ধারন-বহন এবং সঞ্চারণ কতখানি লাভজনক তা বিতর্কসাপেক্ষ। এই নীতির ফলে শুধু যে পরমাণুতে ইলেকট্রন প্রবেশের সিরিয়াল বুঝতে ভুল করি তা না, এর কারণে লেখক এবং টিচার আরও এক গাদা ‘শিক্ষাগত চাপা’ মারতে বাধ্য হন। চাপে পড়ে তারা আরও লম্বা লম্বা ব্যাখ্যা বের করতে থাকেন।
এই পিচ্ছিল আউফবাউ নীতি আরও বলে 4s , 3d এর চেয়ে কম শক্তিসম্পন্ন বা 5s এর শক্তি 4d এর চেয়ে কম- যা আসলে সব পরমাণুর জন্য সত্য না।
নাইন-টেনের ক্লাসে আমরা যেমনটা বলি- নিষ্ক্রিয় গ্যাস কারো সাথে বিক্রিয়া করে না, এমন কি নিজেদের সাথেও না! সেই ছেলেপেলেগুলোই উপরের ক্লাসে উঠে দেখে নিষ্ক্রিয় গ্যাস গণ্ডায় গণ্ডায় বন্ধন করছে তখন কিন্তু মানবজাতির উপর বিশ্বাস উঠে যায়
তাই পিচ্ছিল আউফবাউ নীতিটিকে এত্ত গ্লোরিফাই না করে বরং এই নীতি দিয়ে কতটুকু পর্যন্ত করা যায় আর কতটুকু আওতার বাইরে আছে সেটার সম্পর্কে শুরু থেকেই সবাইকে আঁচ দিয়ে রাখাটাই উপযুক্ত মনে করি।
References:
The following references are among the few that give the correct explanation;
S-G. Wang, W. H. E. Schwarz, Angew. Chem. Int. Ed. 2009, 48, 19, 3404–3415.
S. Glasstone, Textbook of Physical Chemistry, D. Van Nostrand, New York, 1946.
D.W. Oxtoby, H.P. Gillis, A. Campion, Principles of Modern Chemistry, Sixth Edition,
Thomson/Brooks Cole, 2007.
https://ericscerri.blogspot.com/2012/06/trouble-with-using-aufbau-to-find.html
General Reference on the Periodic Table
Eric Scerri, A Very Short Introduction to the Periodic Table, Oxford University Press, 2011

সর্বশেষ এডিট : ২০ শে নভেম্বর, ২০১৮ রাত ১২:৩১


 অনুগ্রহ করে অপেক্ষা করুন। ছবি আটো ইন্সার্ট হবে।
অনুগ্রহ করে অপেক্ষা করুন। ছবি আটো ইন্সার্ট হবে।







